|
V.
Debreceni Kardiológiai Napok
2000. március
2 - 4. Debrecen — DOTE
|
|
a teljes elõadás hangfelvétele: |
Dr. Hegedűs Ida (Debrecen) |
Bevezetés
A klinikai gyakorlatban csak néhány évtizede használatos echokardiográfia eleinte elsõsorban a veleszületett és szerzett szívbillentyûhibák diagnosztikájában nyújtott segítséget a kardiológusnak. Az iszkémiás szívbetegségeknél e módszer korábban csak a szívinfarktus szövõdményeinek kimutatásában, majd a falmozgás zavarok elemzésében bírt jelentõséggel. Késõbb a falmozgás zavarok provokálása gyógyszerrel, illetve a nem mozgó területek viabilitásának kimutatása ugyancsak gyógyszeres terheléssel már jelentõsen bõvítette a szív ultrahang diagnosztikus potenciálját. Manapság az új módszerek (Coronary-flow reserve meghatározás, DMI, kontraszt-echokardiográfia, IVUS, 3-dimenziós technikák) az iszkémiás szívbetegségek vizsgálatában újabb távlatokat nyitnak, s az echokardiográfiás technikák az izotópos, a PET módszerekkel, valamint az angiográfiával együttesen értékelve egyre több, és pontosabb információt nyújtanak, ismereteink bõvülése mellett jelentõségük a betegellátásban is egyre fontosabbá válik.Szívizom Doppler
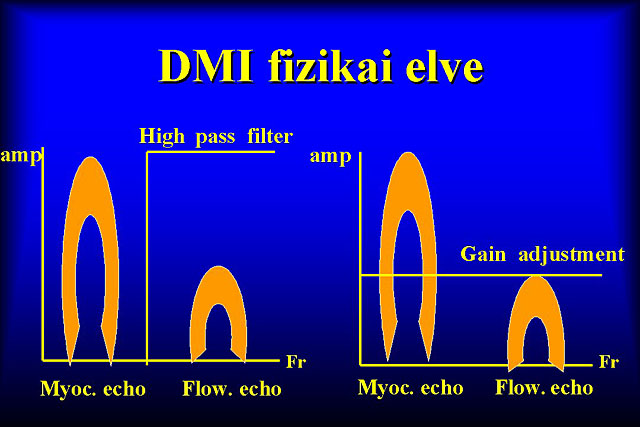
A mozgó szövetek leképezésére alkalmas Doppler módszer a Szöveti Doppler (Doppler Tissue Imaging), melynek a szívizomra specializált változata a Szívizom Doppler (Doppler Myocardial Imaging). Elve a véráramlás Doppler ábrázolásához hasonló, de a transzducer a véráramból származó kisebb amplitúdójú hullámokat egy „gain-kiigazítás”-os módszerrel kiküszöböli, csak a szívizomból visszavert nagy amplitúdójú hullámok kiértékelésére kerül sor. Fontos a gép megfelelõ technikai színvonala, nagy „dynamikus range”, magas „frame rate” a kívánalom a jó képminõség eléréséhez.A DMI klinikai értékeléséhez alapvetõ ismerni, hogy a bal kamra minden szegmentuma a szív „gravitációs pontja” felé mozdul el, így a csúcsról készült 4-üregi, 2-üregi, 3-üregi metszeteken a csúcs ellentétes színnel ábrázolódik, mint a bazális és középsõ szegmentumok. Egészséges szíven a bázis és a csúcs között longitudinális, a falon belül az epikardiális és az endokardiális rétegek között intramurális grádiens mérhetõ. A Velocity-móddal 2-dimenziós, M-mód metszetek készíthetõk, valamint pulzatilis Doppler görbe vehetõ fel minden egyes szegmentumból. Ez utóbbi segítségével számszerûsíthetõek a szisztolés, a kora- és késõdiasztolés sebességek, valamint a szisztolés és a diasztolés idõintervallumok.
A klinikumban a Szívizom Doppler jelenleg a következõ esetekben nyújt segítséget:
1, Kis sebességek: rossz bal kamra szisztolés funkciót jelentenek – dilatációval, illetve csökkent bal kamra funkcióval járó szívizombetegségekre jellegzetesek.
2, Állatkisérletek, valamint emberen PTCA során igazolt, hogy akut iszkémiában un. késõ-szisztolés vastagodás (late-systolic thickening) jelenik meg, mely mind 2D-vel, mind M-mód térképen, mind PD-vel jól ábrázolható. A késõ-szisztolés kontrakciós hullám megjelenése elõtt már észlelhetõ a koradisztolés sebesség csökkenése, az E/A arány csökkenése.
3, Saját adataink szerint a hibernált szívizomra a koraszisztolés kontrakció jellemzõ, a diasztolés sebességek az akut iszkémiához hasonlóan viselkednek.
4, Terheléses echocardiográfia során a sebességek növekednek, az iszkémiás szegmentumra az E/A arány megfordulása, valamint a szisztolés sebesség nem-növekedése – esetleg csökkenése jellemzõ.
5, Bal kamrai kontraktilis rezerv meghatározásokat végezve DMI-vel azt találtuk, hogy 5 cm/sec-s szisztolés sebesség növekedés legalább 25%-s ejekciós frakció növekedéssel jár, s ha a szívizom kontraktilitási hibája iszkémiás eredetû, már kis dózisnál is megjelenik az iszkémiára jellemzõ késõ-szisztolés vastagodás.
5, Jól elkülöníthetõ a HOCM és a szekunder bal kamra hypertrophia a PD görbe formaanalízise alapján.
6, Jól mérhetõ a jobb kamra falvastagsága, becsülhetõ a jobb kamra szisztolés és diasztolés funkciója.
7, A gyorsulás, vagy Acceleration-mód segítségével a kamrai aktiváció idõbeli sorrendje jól tanulmányozható. Különbség van a normál és a pacemaker-rhythmus között, jól felfedezhetõ a WPW-s köteg.
Új módszer a „Strain-rate Imaging”, mely az iszkémia kimutatásának újabb lehetõsége.
IVUS
Az intravaszkuláris ultrahang diagnosztikát egy technikai lehetõség (a miniatürizálás), valamint egy klinikai igény (az angiográfia korlátai) hozták létre. A koszorúér szûkületek morfológiája nem egységes, a plakkok egy része un. soft plakk, más részük fibrózus, ismét más részük meszes. Ezek terápiája sem egységes, s a megfelelõ intervenciós módszer kiválasztását segíti az IVUS, mivel lehetõvé teszi plakk strukturájának elemzését, valamint az intervenció eredményének értékelését. A prognózis szempontjából az intervenció után végzett IVUS-nak nagy jelentõsége van.
Az intravaszkuláris ultrahang 20-40 Mhz-s transzducerrel képzi le az érfal rétegeit, így a felbontóképessége lényegesen nagyobb, mint a transztorakális felvevõfejé. A penetrációja természetesen kisebb, de mivel az érfal csak néhány mm vastag, ez elegendõ a megfelelõ képminõséghez. Kétféle készülék van forgalomban: a forgófejes, egy kristályos, motorral meghajtott mechanikus készülék (Boston Scientific), valamint a 64 kristályos phased array transduceres „Endosonics” nevû készülék.Az IVUS katéter 2,9-3,5 French méretû (0.9 mm átmérõjû), tehát diagnosztikai célokra alkalmas (a koszorúér szignifikáns szûkületein is átfér). A diagnosztikus katéterek mellett PTCA (Percutan Transluminal Coronary Angioplasty) végzésére alkalmas különbözõ méretû ballonokkal felszerelt katéterek is kaphatók, melyek természetesen drágábbak a diagnosztikus katétereknél, de velük az intervenció ideje lerövidül.
A vizsgálat technikai kivitelezése
A koszorúér-angiográfián látott szûkület alá vezetjük az érben az IVUS-katétert, s kézzel, vagy motor segítségével (mely garantálja az egyenletes sebességet, s így hosszirányú méréseket is lehetõvé tesz az érben) a szûkületen át visszahúzzuk az eszközt (pull-back) a betegnek tartott érszakaszon, így maga a szûkület, annak mögöttes szakasza, valamint az azt megelõzõ ér állapota is jól tanulmányozható. Közben folyamatosan történik az ér keresztmetszeti leképezése, s az Endosonics készülék alkalmas a keresztmetszeti képekbõl 2, illetve 3 dimenzióban rekonstruálni a koszorúeret. Így lehetõség van a szûkület, illetve a referencia ér átmérõjének, areájának a mérésére, a szûkület mértékének meghatározására, valamint a plakk morfológiájának részletes elemzésére.Az IVUS vizsgálat eredményeinek felhasználása az intervenció során
A plakk morfológiája határozza meg a választandó intervenció módját. A soft plakk okozta szûkület PTCA-val megoldható. A meszes plakk rotablator alkalmazásával kezelendõ. Az érfal disszekciója esetén sztent-implantáció lehet a megoldás. Sztent-implantáció elõtt, illetve PTCA elõtt az ér átmérõjének és areájának mérésével a PTCA-s ballon, illetve a sztent mérete kiválasztható. Az intervenció elvégzése után az eredmény IVUS segítségével ellenõrizhetõ. A reszt-sztenózis mértéke, a sztent kinyitásának mértéke, s az esetleg bekövetkezett disszekció IVUS segítségével jól megítélhetõk, a hibák korrigálhatók, a prognózis is becsülhetõ.
Az IVUS alkalmazásával kapcsolatos eddigi tanulmányok
Guide: IVUS illetve QCA (Quantitativ Coronaria Angiographia) vezérelt PTCA eredményességét hasonlították össze PTCA után 6 hónappal. Azt találták, hogy az IVUS vezérelt PTCA után kisebb a resztenózis mértéke (32% vs. 45%). A prognózis annál kedvezõbb, minél kisebb a reziduális szûkület az interevenció végén.
SURE: PTCA és DCA (Direct Coronary Atherectomy) eredményeit hasonlították össze 6 hónappal az intervenció után. A DCA csoportban szignifikánsan nagyobbnak bizonyult az érátmérõ, mint PTCA után. A plakk mérete a DCA csoportban 71%-ban, a PTCA csoportban 57%-ban csökkent. PTCA után 73%-ban az érátmérõ csökkenése, 27%-ban a plakk növekedése okozta a resztenózist. Az érátmérõ-csökkenés oka valószínûleg a ballonos tágítás során az érfalra nehezedõ nagy nyomás okozta „recoil” lehet. Mindebbõl az következik, hogy az intervenciók során a PTCA-val szemben preferálni kell a sztent-implantációt, hogy elkerüljük az érátmérõcsökkenés okozta resztenózist.
STRUT: Azt vizsgálták, hogy jó angiográfiás intervenciós eredmény után mit mutat az IVUS. Az eredmény az volt, hogy teljesen jónak tûnõ angiogramm mellett is 22%-ban redilatációra van szükség. Ezt követõen 12%-ban alakult ki kis disszekció (edge tear).Music: Sztent-implantáció után közvetlenül, majd 6 hónappal IVUS utánvizsgálatok történtek. Ha a sztent-area az ér-areának legalább a 80%-a volt, akkor a sztent trombózis incidenciája csak 0,6%, CABG szükségessége 1,2 %, az összes revaszkularizáció incidenciája pedig 4,6 % volt. A sztent implantáció szövõdményei tehát elsõsorban a nem kellõ mértékû sztent-kinyitásból adódnak. Ha a sztent-area nem okoz jelentõs ér-area csökkenést, a prognózis jó.
Benestent és a Stress tanulmányok szerint a sztent-beültetés utáni resztenózis incidenciája lényegesen kisebb, mint PTCA után, csupán 10%-nak adódott. Figyelembe kell azonban venni, hogy ezek a tanulmányok még a nagy nyomással történõ sztent-nyitás elõtti korszakra vonatkoznak.Összefoglalás
Az echokardiográfia egyre nagyobb teret nyer az iszkémiás szívbetegségek diagnosztikájában. A Szívizom Doppler lehetõvé teszi az akut és krónikus iszkémia kimutatást szegmentálisan, a szisztolés és diasztolés funkció globális és regionális értékelését, s ha mindezt stressz-echokardiográfiával kombináljuk az eredmények még meggyõzõbbek.
Az IVUS az intervenciós kardiológiában pontos morfológiai adatokat nyújtva segít az intervenció típusának megválasztásában, az eredmények értékelésében, valamint a prognózis megítélésében.Irodalom
1.) Ausma J, Schaart G, Thone F, Shivalkar B, Flameng W, Depre C, Vanoverschelde JL, Ramaekers F, Borgers M. Chronic ischaemic viable myocardium in man: aspects of dedifferentiation. Cardiovasc. Pathology 1995; 4: 29.
2.) Ausma J, Cleutjens J, Thone F, Flameng W, Ramaekers F, Borgers M. Chronic ischaemic myocardium:Intersticial changes. Molecular and Cellular Biochemistry 1995; 147: 35.
3.) Bach DS, Armstrong WF, Donovan CL, Hummel JD, Bolling SF, Muller DW. Quantitative assessment of regional systolic and diastolic myocardial velocities during transient ischaemia and reperfusion. Circulation 1990; 90: 1.
4.) Cao T, Shapiro SM, Bersohn MM, Liu SC, Ginzton LE. Influence of cardiac motion on Doppler measurements using in vitro and in vivo models. J Am Coll Cardiol 1993; 22: 271.
5.) Derumeaux G, Koning R, Eltchaninoff H, Tron C, Cribire A, Letac B. Assessment of regional systolic and diastolic myocardail velocities by pulsed Doppler tissue imaging during transient ischaemia and reperfusion. Eur Heart J 1995; 17: 414.
6.) De Landsheere C, Raets D, Pierard L, et al. Regional myocardial perfusion and glucose uptake: Clinical experience in 92 cases studied with positron tomography, in Schmidt HAE, Chambron J (eds): Nuclear Medicine: Quantitative Analysis in Imaging and Function. Stuttgart, Schattauer Verlag, 1985; 245.
7.) Donovan CL, Armstrong WF, Bash DS. Quantitative Doppler Tissue Imaging of the left ventricular myocardium: Validation in normal subjects. Am Heart J 1995; 130: 100.
8.) Dunn RB, Griggs DM, Transmural gradients in ventricular tissue metabolits produced by stopping coronary blood flow in dog. Circ Res : 1995; 37: 438.
9.) Drodz J, Schön F, Nesser HJ, Erbel R. Colour coded tissue Doppler echocardiography- a new method for quantification of cardiac wall motion Eur J C P E 1994; 4: 248.
10.) Ferrari R, Ceconi C, Curello S, Benigno M, La Canna G, Pepi P, Ferrari F, Visioli O. Different outcomes of the reperfused myocardium: insights into the comments of stunning and hibernation. Int J Cardiol 1998; (65 Suppl): S7.
11.) Erbel R, Nesser HJ, Drozdz J. Atlas of Tissue Doppler Echocardiography-TDE Darmstadt: Steinkopff, Springer, 1995
12.) Gorcsan J, Katz WE, Mandarina WA, Pinsky MR. Heterogenous left ventricular septal and posterior wall velocities: quantitative temporal assessment by myocardial color Doppler Imaging. Circulation: 1989; 90: 1.
13.) Fülöp T, Hegedûs I, Édes I. The Examination of the Left Venticular Contactile Reserve by Doppler Myocardial Imaging Technique In press: Noninvasiv J Cardiology
14.) Hegedûs I, Voith L, Péter A, Kõszegi Zs, Édes I. What is difference in the Doppler Myocardial Imaging Pulsed Doppler spectrum between acute and chronic myocardial Ischemia? Cardiovascular Imaging 11(1):129-133, 1999
15.) Heinrich R, Schelbert MD. Measurements of Myocardial Metabolism in Patients with Ischemic Heart Diasese. Am J Cardiol 1998; 82: 61K.
16.) Heusch G. and Schulz R. Endogeneous Protective Mechanism in Myocardial Ischemia: Hiberbnation and Ischemic Preconditioning. Am J Cardiol 1997; 80(3A): 26A.
17.) Maybaum S, Ilian M, Mogilevsky J, Tvizoni D. Improvement in ischemic parameteres during repeated exercise testing a possible model for myocardial preconditioning. Am J Cardiol 1997; 79: 75.
18.) Sutherland GR, Stewart MJ, Groundstroem KW, Moran CM, Fleming A, Guell-Peris FJ, Riemersma RA, Fenn LN, Fox KA, Mcdicken WN Color Doppler myocardial imaging: a new technique for the assessment of myocardial function.
J Am Soc Echocardiogr 1994; 7: 441.19.) Raisinghani A, Donaghey L, Nozaki S, Dittrich H, DeMaria A. New approaches to the evaluation of left ventricular function: assessment of transmural myocardial velocity gradients and diastolic relaxation rates by Doppler tissue imaging. Circulation 1994; 90: 1.
20.) Palka P, Lange A, Fleming AD. Doppler Tissue Imaging. Myocardial wall motion velocities in normal subjects. J Am Soc Echocard 1995; 15: 659.
21.) Palka P, Lange A, Fleming AD Age-related transmural peak mean velocities and peak velocity gradients by Doppler Myocardial imaging in normal subjects. Eur Heart J 1996; 17: 940.
22.) Uren NG.: An Introduction to Intravascular Ultrasound Remedica, 1996
23.) DiMario C, Görge G, Peters R, Kearney P, F.Pinto, Hausman D, Birgelen C, Colombo A, Mudra H, Roelandt J and Erbel R. Clinical Application and Image Interpretation in Intracoronary Ultrasound Eur H J: 19: 207-229, 1998
24.) Jaegere DP, Mudra H, Figulla H, AlmagoriY, Doucet S, Penn I, Colombo A, Hamm C, Bartorelli A, Rothman M, Nobuyoshi M, Yamagucchi T, Voudris V, DiMario C, Makovski S, Hausmann D, Rowe S, Rabinovich S, Sanamura S and ES GA. Intravascular ultrasound-guided optimized stent deployment Eur H J: 19:1214-1223,1998