
 |
V.
Debreceni Kardiológiai Napok
2000. március
2 - 4. Debrecen — DOTE
|
|
|
(nukleáris kardiológiai módszerek, PET) Dr. Kőszegi Zsolt, Dr. Galuska László (Debrecen) |
Az ischaemiás szívbetegség diagnosztikájában az izotópos képalkotó eljárások közül legnagyobb jelentõséggel a vérátáramlást vizsgáló tomografikus szívizom szcintigráfia (single photon emission computed tomography: SPECT) terjedt el. A szívizom-metabolizmus vizsgálatára az utóbbi években hazánkban is elérhetõvé vált a pozitronemissziós tomográfia (PET).
Igaz, hogy csak a coronarográfia nyújt lehetõséget annak eldöntésére, hogy coronariaszûkület esetén milyen intervencióra van lehetõség, azonban a beavatkozás szükségességét nem annyira a koszorúérfestéssel megítélhetõ anatómiai kép, inkább annak funkcionális következményét jelentõ szöveti perfúziós és metabolikus eltérések határozzák meg. Így ischaemiás szívbetegségben az izotópos szívizom vizsgálatoknak nem csak azért játszanak nagy szerepet, mert a terheléses EKG-nál érzékenyebben és specifikusabban diagnosztizálhatóak általuk a szignifikáns coronariastenosis jelenléte, hanem azért is, mert pontosan mutatják az egyes coronarialéziók funkcionális következményeit (I. táblázat).
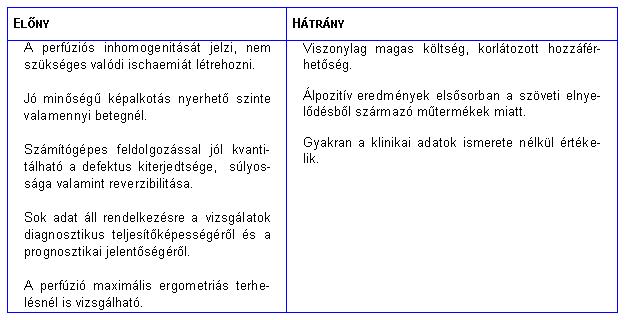
I. táblázat
A perfúziós szcintigráfia elõnyei és hátrányaiSPECT
A SPECT háromdimenziós képet hoz létre a jelzett molekulák koncentrálódásáról. A SPECT kamera körülforgatásával detektálható a szívizomhoz a vérátáramlással arányosan eljutó perfúziós jelzõanyag aktivitásának eloszlása. A számos szögbõl történõ adatgyûjtést követõen a CT-hez hasonló rekonstrukció történik, majd megjeleníthetõk az egyes balkamarai szeletek. A szokásos értékelés során metszeti képsorozatokat nyerhetünk a bal kamra tengelyére merõleges síkokban (rövid tengelyû metszetek), a tengellyel párhuzamos függõleges (szaggitális metszetek) és a vízszintes síkokban (horizontális metszetek). A bal kamra egészét . kiterítve. polar map térképet készíthetünk, amelyen a szívcsúcs a térkép közepére kerül, és balra a szeptális, jobbra a laterális, felül az anterior, alul pedig az inferior szegmentumok találhatóak (1. ábra).
A vérátáramlás jelzõanyagaként régebben használt tallium-201 klorid (201TlCl) a kálium analógjaként jut be a sejtekbe, majd négyórás felezési idõvel mosódik ki a sejtbõl. Az utóbbi években egyre gyakrabban a 99-m-technéciummal (99mTc) jelzett MIBI-t alkalmazzák a szívizom perfúzió vizsgálatára. A MIBI intracelluláris anyagcsere-folyamatok révén kötõdik a mitochondriumokhoz. A 99mTc elõnye a 201Tl-vel szemben, hogy fotonjának nagyobb energiája miatt jobb minõségû képalkotást tesz lehetõvé. Mindkét izotóppal végezhetõk terheléses vizsgálatok is, így a coronariaartéria rezervkapacitása jól megítélhetõ. A terhelés alatt készült felvételt a nyugalmi vizsgálathoz viszonyítjuk (2. ábra).
A nyugalmi felvételek azon túlmenõen, hogy alkalmasak a terheléskor készült vizsgálatokkal történõ összevetésre, bizonyos mértékig a szívizom életképességére is következtetni engednek. A nyugalmi 201TlCl vizsgálatot követõen újabb radiofarmakon beadása nélkül néhány órával késõbb újabb felvételt készítve a kialakuló átrendezõdés (redisztribúció) azt jelzi, hogy egyes szegmentumokban a jelzõanyag beépülése nehezebben következik be, és/vagy kimosódása lassabb. A részlegesen vagy teljesen elzáródott koszorúér ellátási területéhez tartozóan az elhúzódóbb beépülést az magyarázza, hogy ide az izotóp csak a kollaterálisokon keresztül vagy a jó vérellátású területekrõl kimosódva juthat el. A nyugalmi vizsgálat alkalmával észlelhetõ késõi beépülés (reverzibilis defektus) jelzi az adott terület életképességét (viabilitás), míg a heges, irreverzibilisen károsodott területeken a fix, tehát a korai és a késõi felvételen egyaránt kimutatható perfúziós defektusokkal találkozunk ( 1 , 2 , 3, 4 ).
PET
A pozitronemissziós tomográfia lényege, hogy pozitron kibocsátással bomló izotóppal jelzett biológiailag aktív jelzõmolekulákat juttatunk a vizsgálandó szervezetbe, majd a szervezetbõl származó szétsugárzási fotonokat egy detektorrendszerrel érzékeljük, majd egy számítógépes program segítségével kétdimenziós eloszlástérképpé rekonstruáljuk.
Az életképesség vizsgálatok arany standardjának a glükózanalóg 18F-fluoro-dezoxi-glükózt (18FDG) használjuk, amely a viabilis szívizomsejtek jelölésével jól elkülöníti a heges és a károsodott vérellátás miatt rosszul összehúzódó . alvó. (hibernált) de még megmenthetõ szívizmot, ezáltal elõre jelezhetõ a koszorúér-áthidalásos (bypass) mûtét eredményessége.
A vérátáramlás csökkenése a viabilis szívizom fokozott glükózfelvételét hozza létre, így a hibernált miokardiumra jellemzõ viszonylag megtartott metabolikus aktivitás a perfúziós vizsgálattal történõ összehasonlítás révén mutatható ki.
Perfúziós PET jelzõanyag (13NH4, H215O) hiányában elfogadott, hogy nyugalmi SPECT vizsgálat alkalmával a 99mTc- MIBI által meghatározott aktivitáshoz viszonyítják az 18FDG-felvételt. Akkor beszélünk mismatchrõl, ha egy
szegmentumban a perfúzióhoz képest 1,2x nagyobb 18FDG-aktivitás észlelhetõ (3. ábra). Egy másik megközelítés
szerint maga az 18FDG-felvétel mértéke is irányadó lehet az életképesség tekintetében. Ha a normál felénél nagyobb relatív aktivitás észlelhetõ egy szegmentumban, akkor az arra utal, hogy a szívizom nem halt el teljesen.
Azért is lehet erre az adatra támaszkodni, mert a PET vizsgálat alkalmával más izotópos technikákkal ellentétben ténylegesen meghatározható az egyes szegmentumok radioaktivitás tartalma, hiszen az elnyelõdés külsû sugárforrás segítségével pontosan mérhetõ és korrigálható. ( 5 , 6 , 7 , 8 ).A metabolikus PET vizsgálatok segítséget nyújthatnak a szívizominfarktus szövõdményeként kialakuló balkamrai aneurysmák anatómiai vagy funkcionális jellegének megítélésében is ( 10 ). Az anatómiai aneurysmák esetében az épnek tekinthetõ területekhez viszonyított relatív 18FDG-aktivitás nem éri el a 25%-ot. Az elkülönítés jelentõségét az adja, hogy az anatómiai aneurysmákat érdemes kimetszeni (rezekálni), míg a funkcionális aneurysmák területéhez vezetõ koszorúeret akkor indokolt áthidalni, ha az életképesség igazolható. A kimetszés megtervezéséhez, s a rezekciós vonal kijelöléséhez is segítséget jelent a heges terület PET-tel történõ pontos kimutatása ( 9 ).
A glükózfelvételt jelzõ 18FDG a glükózhoz hasonlóan jut a miokardiális sejtekbe, de ott foszforilálódást követõen nem metabolizálódik tovább, hanem 18FDG-6-foszfát formájában akkumulálódik. Dinamikus vizsgálati körülmények között a Patlak analízis alapján kvantifikálható az eredõ foszforiláció. Az aktuális vércukorszint ismeretében kiszámítható a regionális miokardiális glükózutilizáció (rMGU) mol/min/szívizomszövet g mérték-egységben. Mivel a miokardium glükózhasznosítása komplex módon szabályozódik, más értékek várhatók éhgyomri körülmények között mint per os szénhidráttöltés után vagy a mostanában javasolt hyperinzulinaemiás-euglycaemiás clamp alkalmazása során. Az utóbbi technika alkalmat ad az inzulinérzékenység/rezisztencia szívizomszintõ manifesztációjának meghatározására is ( 10 , 11 ).
Irodalom
1.) Datz FL, Gullberg G, Gabor FV, Morton KA: SPECT myocardial perfusion imaging update Semin Ultrasound CT MR. 1991 12(1): 28-44
2.) Verani MS: Myocardial perfusion imaging versus two-dimensional echocardiography: Comparative value in the diagnosis of coronary artery disease J Nucl Card. 1994, 4:399-414
3.)Koszegi Z, Maes A, Piessens J,Van de Werf F, Mortelmans L: Segmental comparison between coronary angiography and PET reveals low predictive value of epicardial flow for viability. European Heart Journal. 1998/ 19: 959-967
4.) Milan E, Zoccarato O, Terzi A, et al: Technetium-99m-sestamibi SPECT to detect re-stenosis after successful percutaneous coronary angioplasty. J Nucl Med. 1996, 37(8): 1300-5
5.) Tillisch J, Brunken, R., Marshall, R. et al: Reversibility of cardiac wall motion abnormalities predicted by positron emission tomography. N. Engl. J. Med. 314:884, 1986
6.) Kõszegi Zs, Szakáll Sz, Trón L, Hegdûs I, Édes I, Péterffy Á: Nagykockázatú koszorúér bypass mûtét eredményességének elõrejelzése pozitron emissziós tomográfiával. Orvosi Hetlilap. 1997; 138:1691-1693
7.) Bonow RO, Dilsizian V, Cuocolo A, et al: Identification of viable myocardium in patients with chronic coronary artery disease and left ventricular dysfunction. Comparison of thallium scintigraphy with reinjection and PET imaging with 18F-fluorodeoxyglucose. Circulation. 1991, 83(1) : 26-37
8.) Schelbert HR: Positron emission tomography for the assessment of myocardial viability. Circulation 1991, 84(Suppl):I122-I131
9.) Szûk T, Kõszegi Zs, Csapó K, Voith L, Édes I, Vaszily M, Tamás É, Bajnok L, Balkay L, Trón L: Angiological and 18FDG-PET characteristic of left ventricular functional and anatomical aneurysms. J Nucl Card. 1997; 4: S88
10.) Kertész A, Kõszegi Zs, Fülöp T, Szakáll Sz, Balkay L, Emri M, Trón L: Dinamikus 18FDG-PET vizsgálat a szívizom glükózfelvételének mérésére. Cardiológia Hungarica, 98/suppl. 1:26
11.) Knuuti MJ, Nuutila P, Routslainen U, Saraste M et al: Euglycemic hyperinsulinemic clamp and oral glucose load in stimulating myocardial glucose utilization during positron emission tomography. J Nucl Med. 1992; 33: 1255-1262
1. ábra
Kis kiterjedésû anterior és nagyobb poszterolaterális reverzibilis perfúziós defektus
(Non-Q infarctus után, a terheléses EKG nem volt pozitív.)
2. ábra
Hibernáló mikoardium (LAD és RCA elzáródás)
Felül dipyridamol MIBI SPECT terheléses és nyugalmi rövidtengelyû metszetei, alul FDG PET identikus szeletei. A fix anterior, szeptális és inferior perfúziós defektusok területén a metabolikus aktivitás csaknem teljesen megtartott.3. ábra
Az elmúlt évek kutatásai sok új ismerettel gazdagították tudásunkat az erek mûködésével kapcsolatban. Kiderült, hogy az érbelhártya, az endothelium önálló szerv, mely structuralis és functionalis értelemben is specialis sejtekbõl / endothel sejtekbõl / épül fel.