 |
Herszényi László
SE, ÁOK II. Belgyógyászati Klinika,
Budapest
A rheumatoid arthritises és osteo-arthritises betegek kezelésében a nem-szteroid gyulladáscsökkentő (NSAID) szerek igen hatékonyak: a fájdalom, valamint a gyulladás csökkentése révén jelentősen javíthatják a betegek életminőségét. A krónikus nem-szteroid gyulladáscsökkentőt (NSAID) szedő betegek között a gastrointestinális (GI) szövődmények éves gyakorisága 0.2-1.25%. A rendszeres NSAID szedés mellett az endoszkóposan igazolható gyomor-nyombél fekélyek incidenciája 15-30%. A klinikailag jelentős GI események-szövődmények (vérzés, perforáció, stenosis) gyakorisága jóval alacsonyabb (1.5%). Tekintettel azonban az igen jelentős mennyiségű NSAID fogyasztásra, abszolút értékben ez az arány számottevő.
Fontos meghatározni a klinikailag jelentős GI események szempontjából a nagy kockázatú „high risk" betegcsoportot. A Helicobacter pylori fertőzés és az NSAID a gastro-duodenalis fekélyek kialakulása szempontjából két különálló rizikótényező. Az NSAID által okozott GI szövődmények megelőzésének két fő lehetősége a szelektív-specifikus COX-2 gátlók (coxibok) alkalmazása és a gyógyszeres profilaxis (gastroprotectio). A szelektív (specifikus) COX-2 gátlók (coxibok) kb. 50%-al csökkentik a fekélyek és a súlyos GI szövődmények arányát. A költséghatékonysági szempontokat is figyelembe véve a coxibok használata elsősorban a „high-risk" csoportban indokolt. A gyógyszeres profilaxis leghatékonyabb eszközei a proton pumpa gátló (PPI) szerek. A gyógyszeres profilaxis elsősorban a „high risk" csoportban szükséges.
Bevezetés
Az osteoarthritis-osteoarthrosis (OA) a leggyakoribb izületi betegség a világon (világszerte kb. 355 millió embert érint), prevalenciája az életkorral jelentősen növekszik. Az OA jelentőségét jól tükrözi az a tény, hogy a rokkantság-mozgáskorlátozottság terén az USA-ban az ischaemias szívbetegség után az OA a második helyen áll az 50 évnél idősebb férfiak munkaképtelenségének kiváltó okai között.
A nem szteroid gyulladáscsökkentők (NSAID) hatásosan csökkentik a gyulladást, csillapítják a fájdalmat és a lázat, enyhítik az izületi merevséget-duzzanatot, csökkentik a mozgáskorlátozottságot, elősegítik az izületi funkció fenntartását, mindezek révén jelentősen javítják az életminőséget. Ebből adódik, hogy az NSAID világszerte az egyik legelterjedtebb gyógyszercsoport, pl. az USA-ban a 65 évnél idősebb populáció 10%-a állandó NSAID fogyasztó.
Az NSAID hatásmechanizmusa
Az NSAID szerek gyulladáscsökkentő (prosztaglandin szintcsökkentő) hatásukat a cyclooxygenase (COX) enzim bénításán keresztül fejtik ki. Tisztázódott, hogy két COX izoenzim létezik. A COX-1 enzim minden sejtben jelen van, un. konstitutív, élettani feladatokat lát el. A COX-1 a fiziológiás működéshez szükséges prosztaglandin szintézisért felelős, élettani regulátor szerepét tölti be (gastrointestinális nyálkahártya védelme, veseműködés-vérátáramlás szabályozása, thrombocyták aggregációjának gátlása), mennyisége szinte állandó, bizonyos ingerek hatására kb. 2-3 szorosára növekszik. Ezzel szemben a COX-2 izoenzim gyulladásos ingerekre képződő, un. induktív enzim, amely a nyugvó sejtekben alig mutatható ki, azonban a különböző gyulladásos mediátorok hatására a gyulladásos sejtekben mennyisége 70-80 szorosára nő. Az NSAID készítmények (eltérő mértékben) mindkét enzim működését gátolják. Az acetilszalicilsav (ASA) irreverzibilisen gátolja a COX-1 enzimet, a többi NSAID kompetitív módon, reverzibilisen hat. A gyulladáscsökkentő hatásért a COX-2 gátlás, míg a nemkívánatos mellékhatásokért a COX-1 gátlás a felelős.
A szelektív COX-2 gátlás jelentősége
A két izoenzim térbeli és aminosav szerkezete közötti minimális különbség biztosítja a szelektív gátlás elvi és napjainkban már lehetővé vált gyakorlati megvalósítását. Minden NSAID gátolja a COX enzimeket, de a két izoenzim gátlásának eltérő mértéke közötti különbség alapján eltérő az NSAID-ok terápiás viselkedése. Az ideális NSAID szelektíven gátolja a gyulladásért felelős COX-2 enzimet, de nincs, vagy alig van hatással COX-1 enzimre, amely a szövődményekért felelős. Ezek alapján megkülönböztetünk „nem szelektív", hagyományos NSAID-okat (diclofenac, indomethacin, ibuprofen, naproxen, piroxicam, azapropazon stb), amelyek jelentős mértékben gátolják a COX-1 enzimet; „szelektív" COX-2 bénítókat (meloxicam, nimesulid, nabumeton), amelyek nagyobb arányban bénítják a COX-2 enzimet; és végül a legújabb un. „coxib" kategóriába tartozó „szuperszelektív" specifikus-COX-2 inhibitorokat (celecoxib, rofecoxib). A coxibok több mint 50-70-szer szelektívebben bénítják a COX-2 izoenzimet, mint a hagyományos COX inhibitorok, és többszörösen szelektívebbek a „szelektív" COX-2 gátlóknál, ugyanakkor pl. a rofecoxibnak a klinikumban ajánlott terápiás dózis akár 80-szoros adagjánál sincs klinikailag számottevő COX-1 gátló hatása.
Gastrointestinális mellékhatások
A kedvező klinikai hatások mellett a hagyományos NSAID készítmények alkalmazása komoly mellékhatás rátával jár, amely az Egyesült Királyságban (UK) az összes jelentett gyógyszer mellékhatások 20%-át, míg az USA-ban 25%-át teszi ki. Minél kevésbé szelektív egy NSAID, vagyis minél erősebb COX-1 gátló, annál gyakoribbak a mellékhatások, beleértve a tápcsatornai szövődményeket is.
A nyálkahártya károsodás spektruma a submucosus pettechiális vérzésektől (amelyeknek klinikai jelentősége nem egyértelmű), a felszínes erosiókig, fekélyekig terjedhet, de akár súlyos-életet veszélyeztető szövődmények (vérzés, perforáció) is felléphetnek. Magyarországon mintegy 700 halálesetet regisztrálnak évente.
Az NSAID mellékhatások klinikai jelentősége
Az NSAID szedő betegek 15-40%-ában dyspepsiás panaszok jelentkeznek. Fontos hangsúlyozni, hogy az NSAID-asszociált tünetek nincsenek egyenes arányban az endoszkópos vizsgálat során látott eltérésekkel. Az endoszkópos vizsgálatok során a krónikus NSAID szedők 10-30%-ában peptikus fekélyek (főleg gyomorfekély), 30-50%-ban pedig gyomornyálkahártya erosiók igazolhatók. A fekélyek jelentős részének vélhetően nincs igazi klinikai jelentősége (spontán is meggyógyulnak), ezért a felső tápcsatornai súlyos szövődmények aránya szerencsére jóval kisebb (1-3%). A krónikus NSAID szedő betegek között a gastrointestinális (GI) szövődmények éves gyakorisága 0.2-1.25%. Az NSAID szedők millióira való tekintettel azonban ez az arány abszolút értelemben igen jelentős. A szövődmények morbiditása és mortalitása számottevő. A különböző etiológiájú össz-fekélyes szövődmények 60%-át NSAID okozza, az NSAID eredetű fekélyek 60%-ában pedig először súlyos szövődmény jelentkezik (vérzés, perforáció), ezért az NSAID fekélyek jelentős része un. „néma" (silent) fekély. Az összes tápcsatornai vérzés 30%-a hozható összefüggésbe az NSAID fogyasztással. NSAID szedő fekélybetegekben 4-5-ször gyakoribb a vérzés és nő a perforáció kockázata is. NSAID kezelés mellett ötszörösére nő a hospitalizáció szükségessége. A szövődmények legfontosabb jelentősége, hogy az esetek egy részében végzetesek lehetnek, így pl. a fekélyek okozta mortalitás 30%-a NSAID szedés következménye. Az Egyesült Királyságban (UK) két hónapig tartó NSAID szedés során minden kétezredik kezelés végzetes szövődménnyel végződik. Az USA-ban NSAID szedés miatt évente 16.000 halálesettel kell számolni, amely egy adott időtartam alatt megegyezik az AIDS-el kapcsolatos adatokkal.
A szövődmények terén az NSAID kezelés megkezdése utáni első három hónap jelenti a legnagyobb kockázatot, de akár már néhány napos NSAID szedés után is felléphetnek a szövődmények.
Hangsúlyozni kell, hogy az NSAID szerek nemcsak felső tápcsatornai szövődményeket okozhatnak, hanem a nyelőcső, vékonybél és a vastagbél szintjén is fekélyeket, perforációt, vérzést, szűkületet idézhetnek elő.
Mindezek alapján jól érzékelhető, hogy az NSAID-asszociált GI károsodás komoly gazdasági terhet jelent egy adott ország egészségügyi ellátására. Az USA-ban pl. a rendszeres NSAID szedők esetében a gastrointestinalis betegségekre fordított átlagos betegellátási költség duplája az NSAID-et nem szedőkéhez képest. A gazdasági teher a jövőben tovább nőhet, ha pl. a szívérrendszeri védelem miatt a kis adagú ASA fogyasztás tovább emelkedik.
Az NSAID mellékhatások szempontjából nagy kockázatú „high risk" betegcsoport
Mivel az NSAID asszociált gyomor-nyombél eltérések jelentős része tünetmentes, igen fontos gyakorlati kérdés a fokozott kockázatú „high risk" betegcsoport meghatározása.
Az NSAID asszociált szövődmények szempontjából a fokozottan veszélyeztetett „high risk" csoportot és a relatív kockázatot az 1. táblázat tartalmazza.
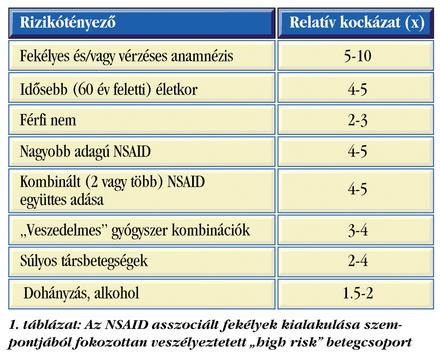 |
A kockázati tényezők közé tartoznak: a fekélyes anamnézis; az idősebb (> 60 év) életkor; a férfi nem; a súlyos társbetegség (pl. szívérrendszeri betegség, súlyos rheumatoid arthritis); az anamnézisben szereplő peptikus fekélybetegség és tápcsatornai vérzés; az alkoholfogyasztás és a dohányzás; a nagyobb adagú vagy kombinált (két vagy több) egyidejű NSAID szedés; az egyidejű anticoaguláns, thrombocyta aggregáció gátló vagy corticosteroid kezelés. Ez utóbbiakat a szövődmények kockázata miatt „veszedelmes" gyógyszer kombinációknak tekinthetjük (2. táblázat). A rizikótényezők feltérképezéséhez nélkülözhetetlen a részletes anamnézis felvétel, ennek keretében pedig értelemszerűen alapvető a betegek által szedett gyógyszerek pontos ismerete. Ezáltal ki lehetne szűrni a „veszedelmes" gyógyszer kombinációkat. A megfelelő anamnézis ismeretében gondosabban tudnánk mérlegelni az NSAID szedés valós szükségességét és a kezelési stratégiát.
A kis dózisú ASA szedők esetében a fő kockázati tényezőt az előzetes tápcsatornai vérzés valamint az egyidejűleg
 |
alkalmazott nem-aszpirin típusú NSAID szedés jelenti, míg az egyéb tényezők (pl. életkor) nem annyira egyértelműek, mint a szokványos NSAID szedés esetében.
Hibák az NSAID kezelés során
Az NSAID szedéssel kapcsolatban elkövetett leggyakoribb hibákat a 3. táblázat tartalmazza.
 |
Közülük a legfontosabbak: gyakran diagnózis nélkül, fájdalomcsillapítóként történik az NSAID adása; hatástalanság esetén újabb és újabb NSAID szer bevezetésére kerül sor; a betegek a panaszok megszűnte után is folytatják a gyógyszerszedést; a különböző NSAID szerek kombinációban történő adása (amelyek hatása rendszerint nem adódik össze, de jelentősen nő a szövődmények aránya); megalapozatlan és nem eléggé körültekintő a „veszedelmes" gyógyszer kombinációk alkalmazása. Háziorvosi rendelőkben történt nemzetközi felmérések szerint a szövődmények szempontjából nagykockázatú „high risk" betegek jó részében nem indokolt az NSAID szedés, különösen a hosszú távú NSAID szedés.
Kezelés
Megelőzés
Az NSAID okozta gastro-duodenopathia kezelésében döntő tényező a megelőzés (4. táblázat).
Jelenleg az NSAID-asszociált tápcsatornai szövődmények kockázatát három módon lehet csökkenteni: a legegyszerűbb az lenne, ha nem alkalmaznánk NSAID szereket, ez azonban rendszerint nem járható út, mivel NSAID szedés nélkül a betegek jelentős csoportjának megromlana az életminősége; a másik két reálisabb lehetőség az újabb, biztonságosabb NSAID szerek (coxibok) ill. a gastroprotectio alkalmazása.
Szelektív COX-2 NSAID szerek (Coxibok)
A COX-2-szelektív NSAID szerek (coxibok) a megelőzés terén óriási előrelépést jelentenek. Számos vizsgálat igazolta,
 |
hogy a coxibok (celecoxib, rofecoxib) alkalmazása során a tápcsatornai mellékhatások gyakorisága szignifikánsan ritkább (1/10-e), mint a nem szelektív COX gátlóké; prospektív vizsgálatokban pedig a coxibok által kiváltott fekélyek aránya megegyezik a placebo csoportéval. A coxibok összességében 50-60%-al csökkentik a klinikailag jelentős GI események-szövődmények relatív kockázatát. Ezért a nagykockázatú („high risk") csoportba tartozó betegek esetében feltétlenül a coxibok alkalmazására kell törekedni.
Értelemszerűen, ha a költségektől eltekintenénk, akkor a gasztroenterológus szempontjából minden beteg esetében coxibokat kéne alkalmazni. Fontos kérdés azonban, hogy éves szinten hány beteget kell coxibokkal kezelni ahhoz, hogy ez a jelentős rizikócsökkenés bekövetkezzen /number needed to treat (NNT)/? Egy klinikailag fontos GI esemény megelőzéséhez azonban 40-65 beteget kell hagyományos NSAID szerről coxibra átállítani, míg egy súlyos GI szövődmény megelőzéséhez 120-125 beteg coxibra történő átállítására van szükség. Ezen számok tükrében a coxibok alkalmazásával kapcsolatban előtérbe kerülnek a költség-hatékonysági kérdések. Nemzetközi adatok alapján a coxibok alkalmazása elsősorban a nagy kockázatú „high risk" csoportban költség-hatékony. Az alacsony kockázatú (normál) populációban továbbra is a hagyományos NSAID szerek alkalmazásának van realitása.
Mindamellett, hogy a coxibok egyértelmű fejlődést jelentettek a GI szövődmények megelőzése terén, meg kell említeni, hogy a krónikus kezelést igénylő betegek esetében a COX-2 szelektív NSAID (coxib) alkalmazása mellett vélhetően a betegek több mint 20%-ban kis-dózisú ASA egyidejű szedésére is szükség lehet a szívérrendszeri védelem céljából. A coxib+ASA kombináció esetében is felmerül a gastroprotectio szükségessége. Mivel e téren viszonylag kevés adattal rendelkezünk és a rendelkezésre álló adatok elsősorban a celecoxibra vonatkoznak, a gastroprotectio szükségességének pontosabb elbírálásához további, nagy esetszámú, mindkét coxibbal történő vizsgálatok szükségesek.
A megelőzés terén a közeljövő lehetséges új gyógyszerei is reményt jelentenek. A kísérletes vizsgálatok arra utalnak, hogy a nitric oxid és az NSAID szerek kombinációja (NO-NSAID) ill. az NO-aszpirin a tápcsatornára nézve biztonságosabbak, mint önmagukban a szokványos NSAID szerek vagy az ASA. Az epidemiológiai vizsgálatok azt igazolták továbbá, hogy a per os vagy transdermálisan alkalmazott nitrát vegyületek az NSAID szerek és a kis dózisú ASA esetében egyaránt 40-60%-al csökkentették a felső tápcsatornai vérzések kockázatát. Ezeket az igen kedvező kezdeti kísérletes és klinikai eredményeket további, nagy esetszámú klinikai vizsgálatokkal kell alátámasztani.
Profilaktikus kezelés (Gastroprotectio)
A költséghatékonyság figyelembevételével, krónikus NSAID szedés esetén az ún. veszélyeztetett („high risk") csoportban ajánlatos a kiegészítő, profilaktikus kezelés (gastroprotectio). Az NSAID-asszociált fekélyek gyógyszeres profilaxisa leghatékonyabban a protonpumpa gátló (PPI) szerek alkalmazásával érhető el. A H2-receptor antagonisták (H2RA) a PPI szerekhez képest kevésbé hatékonyak: a H2RA szerek standard dózisban ugyan csökkentik az NSAID-asszociált duodenális fekélyek incidenciáját, de nem befolyásolják a gyomorfekélyek arányát. Ezért, amennyiben mégis H2RA kezeléssel igyekszünk elérni a megfelelő gastroprotectív hatást, feltétlenül nagyobb, kétszeres dózis alkalmazására van szükség. A prosztaglandin-analóg misoprostol hatását elsősorban az NSAID-asszociált fekélyképződés primer profilaxisában tanulmányozták. A misoprostolnak dózis-függő módon a gyomor- és nyombélfekélyekkel szemben egyaránt védő hatása van, de alkalmazásának határt szabnak a dózis-függő mellékhatások, mint pl. a hasmenés és a hasi görcsök. A költség-hatékonysági szempontokat is figyelembe véve, a PPI szerrel történő gastroprotectio elsősorban a nagy kockázatú („high risk") csoportban tekinthető költségkímélő stratégiának.
A kialakult gastropathia-duodenopathia kezelése
A már kialakult eltérések (fekélyek, erosiók) esetén az első teendőnk az NSAID szedésének felfüggesztése vagy legalábbis a szer dózisának csökkentése.
Az NSAID elhagyása esetén a gyógyulást megfelelő savszekréció gátló kezeléssel segíthetjük elő. E téren leghatékonyabbak a PPI szerek, de a H2RA is megfelelő arányban gyógyítja a már kialakult fekélyeket. A prosztaglandin analóg misoprostol jóllehet gyógyítja a fekélyeket-erosiókat, de alkalmazásának határt szab a gyakori hasmenés, amely a betegek kb. 40%-ában jelentkezhet.
NSAID szedés és Helicobacter pylori fertőzés
Az NSAID-asszociált fekélybetegségben a Helicobacter pylori (H. pylori) szerepe bizonytalan. A fekélyes szövődmények szempontjából a H. pylori és az NSAID szedés független rizikótényezőknek tekinthetők, amelyek külön-külön károsítják a gyomor nyálkahártyát. Az NSAID szedés során a H. pylori eradikációjának szükségessége a szakirodalomban vita tárgyát képezi. Általában elfogadott, hogy az NSAID kezelés előtt elvégzett H. pylori eradikáció csökkenti a fekélyek incidenciáját, ezért tartós NSAID szedés előtt vagy a nagykockázatú („high risk") csoportban érdemes elvégezni az eradikációs kezelést. Irodalmi adatok azonban arra is utalnak, hogy hatékony savszekréció gátló (PPI) kezelésben részesülő NSAID szedő betegekben az eradikáció nem segíti a fekély gyógyulását, továbbá a már elkezdett, folyamatos NSAID kezelés mellett elvégzett eradikáció nem csökkenti a fekélyvérzés kiújulásának kockázatát.
Összefoglalás
Az NSAID szerek jelentősen javítják a rheumatoid arthritises és osteo-arthritises-arthrosisos betegek életminőségét. Az NSAID szerek gastrointestinális toxicitása azonban igen fontos morbiditási és mortalitási tényező. Az NSAID szerek adása alapos körültekintést igényel. Ha figyelembe vesszük az NSAID asszociált gastropathia megelőzése céljából megszívlelendő legfontosabb teendőket (4. táblázat) és megfelelő indikációban alkalmazzuk az NSAID szereket, akkor jelentős mértékben csökkenthetjük a gasztrointestinális mellékhatások kialakulását. Tartós NSAID használata esetében kerülni kell a „veszedelmes" gyógyszer kombinációkat. Jelen ismereteink szerint, tartós NSAID kezelés előtt, a nagy rizikójú betegek esetében a H. pylori fertőzés eradikációja javasolható. A szelektív-specifikus COX-2 gátló szerek (coxibok) 50-60%-al csökkentik a jelentős tápcsatornai események-szövődmények relatív kockázatát. Ezért a nagykockázatú („high risk") csoportba tartozó betegek esetében a coxibok alkalmazását kell előnybe részesíteni. A nagykockázatú betegekben a tartós NSAID kezelés során gastroprotectióra (elsősorban PPI védelemre) kell törekedni. A nagykockázatú betegek esetében a szelektív COX-2 gátló + ASA együttes adása esetén is felmerülő párhuzamos gastroprotectio szükségessége további vizsgálatokat tesz szükségessé.
Az irodalom a szerzőnél rendelkezésre áll.
1088 Budapest, Szentkirályi u. 46.
 |







